Clesrovimab (MK-1654), un anticuerpo monoclonal preventivo en investigación para el virus respiratorio sincitial (VRS) de MSD, redujo significativamente la incidencia de la enfermedad por VRS y las hospitalizaciones en bebés prematuros y a término sanos
January 22, 2025 10:27 am GMT+0000
Madrid, 22 de enero de 2025. MSD (marca comercial de Merck & Co., Inc., Rahway, N.J., USA) (NYSE: MRK) ha anunciado la presentación de resultados positivos del ensayo clínico de fase 2b/3 (MK-1654-004) que ha evaluado clesrovimab, el anticuerpo monoclonal profiláctico en investigación de la compañía diseñado para ayudar a proteger a los bebés de la enfermedad por virus respiratorio sincitial (VRS) durante su primera temporada de VRS. Los resultados, junto con los resultados de análisis interino del ensayo de fase III en curso (MK-1654-007) de clesrovimab, fueron presentados durante IDWeek 2024, celebrada del 16 al 19 de octubre en Los Ángeles, California.
Los resultados de MK-1654-004, un ensayo pivotal de fase 2b/3 controlado con placebo que ha evaluado una dosis única de clesrovimab administrada a bebés prematuros y a término sanos (desde el nacimiento hasta 1 año de edad), cumplieron con todos los criterios de valoración preespecificados, con resultados consistentes tanto en los puntos temporales de 5 meses como de 6 meses. La incidencia de eventos adversos (EA, por sus siglas en inglés) y EA graves fue comparable entre los grupos de clesrovimab y placebo, y no hubo muertes relacionadas con el tratamiento o el VRS durante el estudio.
“El VRS sigue siendo una infección estacional generalizada que puede afectar tanto a bebés sanos como en riesgo y es la principal causa de hospitalización en los bebés”, dijo el Dr. Octavio Ramilo, presidente del Departamento de Enfermedades Infecciosas en el Hospital de Investigación Infantil St. Jude y investigador de los ensayos MK-1654-004 y MK-1654-007. “El estudio MK-1654-004 evaluó un amplio espectro de la enfermedad por VRS, que va desde enfermedades leves tratadas en consulta externa hasta enfermedades graves que requieren hospitalización. Estos resultados prometedores que han mostrado una disminución de la incidencia de la enfermedad por VRS, incluidas las hospitalizaciones, destacan el potencial de clesrovimab para desempeñar un papel importante en ayudar a aliviar la carga continua del VRS en los bebés y sus familias”.
El criterio principal de valoración de la eficacia del ensayo, la reducción de la incidencia de infecciones respiratorias bajas atendidas médicamente (MALRI, por sus siglas en inglés) asociadas al VRS que requerían ≥ 1 indicador de infección respiratoria baja (LRI por sus siglas en inglés) o gravedad en comparación con el placebo hasta el Día 150 (5 meses) postdosis, fue del 60,4% (IC del 95%: 44,1, 71,9, p<0,001). Clesrovimab también redujo las hospitalizaciones asociadas al VRS (criterio de valoración secundario) y las hospitalizaciones por LRI asociadas al VRS (criterio de valoración terciario) hasta el Día 150 (5 meses) en comparación con el placebo en un 84,2% (IC del 95%: 66,6, 92,6, p<0,001) y un 90,9% (IC del 95%: 76,2, 96,5), respectivamente. Clesrovimab redujo la incidencia de MALRI grave (criterio de valoración terciario) en un 91,7% (IC del 95%: 62,9, 98,1).
Además, en un análisis post hoc, la reducción de la incidencia de MALRI que requería ≥ 2 indicadores de LRI y gravedad (un criterio de valoración de MALRI más grave que el criterio de valoración principal de MALRI), fue del 88,0% (IC del 95%: 76,1, 94,0) hasta el Día 150 (5 meses).
En las tablas siguientes se presentan detalles adicionales sobre los datos del ensayo MK-1654-004 en función de la carga de enfermedad por VRS, en orden decreciente de los criterios de valoración de la gravedad de la enfermedad.
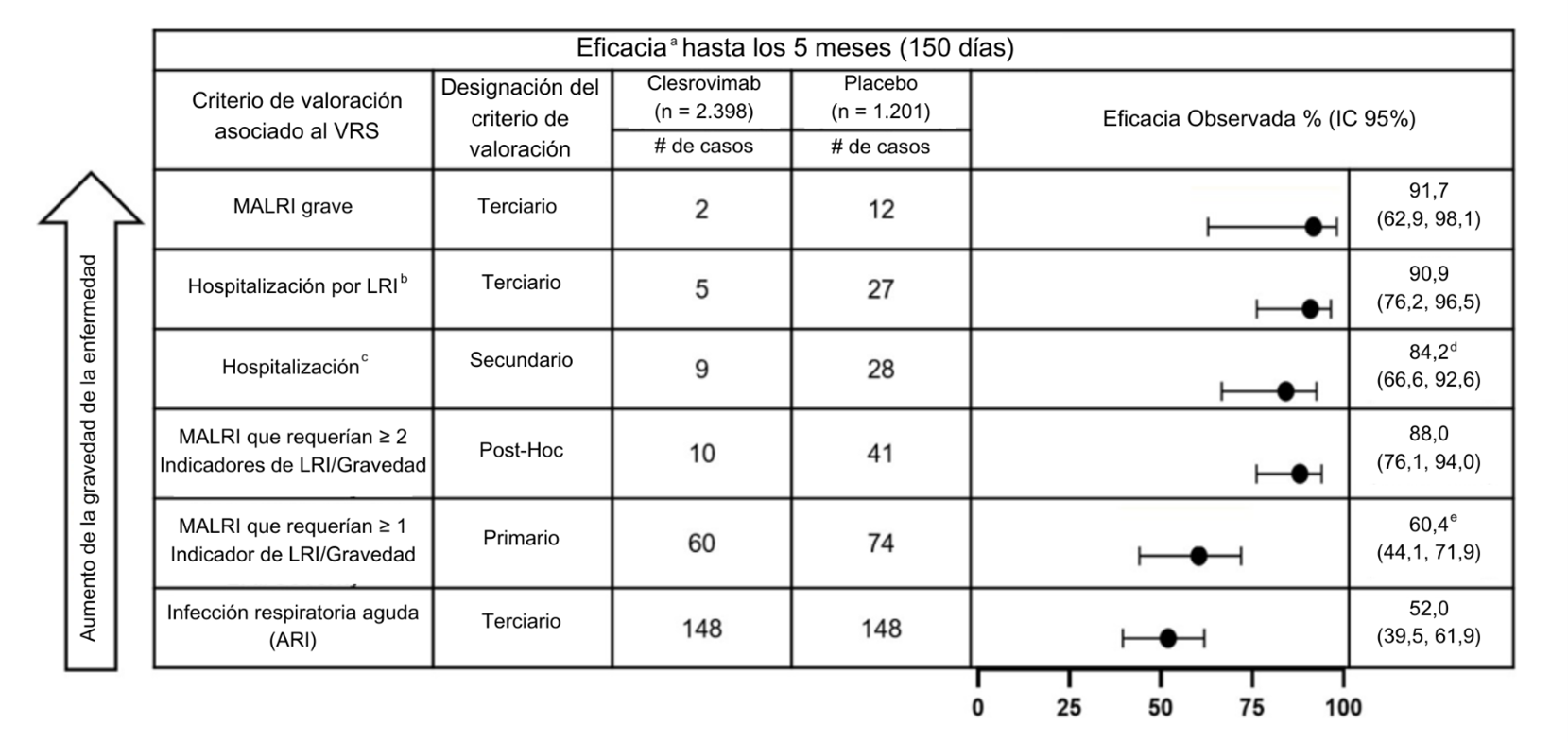

- Población del conjunto de análisis completo.
- Hospitalización por LRI definida como: PCR positiva para VRS e ingreso hospitalario por enfermedad respiratoria y tos o dificultad respiratoria y al menos 1 de los siguientes: sibilancias, retracción de la pared torácica, estertores/crepitantes, hipoxemia, taquipnea, deshidratación debida a síntomas respiratorios.
- Hospitalización asociada al VRS definida como: PCR positiva para VRS e ingreso hospitalario por enfermedad respiratoria.
- Criterio de valoración secundario, p<0,001 (criterio=límite inferior del IC 95% >0%).
- Criterio de valoración primario, p<0,001 (criterio=límite inferior del IC 95% >25%).
Abreviaturas: LRI= Infecciones respiratorias bajas, por sus siglas en inglés; MALRI= Infección respiratoria baja atendida médicamente, por sus siglas en inglés; ARI= Infección respiratoria aguda, por sus siglas en inglés.
MSD también anunció datos de un análisis interino planificado del ensayo MK-1654-007, un ensayo de fase III que evalúa la seguridad y eficacia de clesrovimab versus palivizumab en bebés y niños con mayor riesgo de enfermedad grave por VRS. El criterio de valoración principal del estudio es la seguridad y tolerabilidad de clesrovimab en bebés que ingresan en su primera temporada de VRS. Los resultados de este análisis mostraron que clesrovimab tenía un perfil de seguridad comparable al de palivizumab, y no se informaron eventos adversos graves relacionados con el medicamento hasta la fecha. Las tasas de incidencia de MALRI asociado al VRS que requerían ≥ 1 indicador de LRI o gravedad y las hospitalizaciones asociadas al VRS (criterios de valoración secundarios) también fueron comparables entre clesrovimab (3,6% y 1,3%, respectivamente) y palivizumab (3,0% y 1,5%, respectivamente) hasta el Día 150 (5 meses).
“La amplitud de los datos presentados en IDWeek destaca el potencial de clesrovimab para ayudar a reducir el impacto significativo que el VRS puede tener en los bebés y sus familias, así como la presión sobre los sistemas de salud debido a las altas tasas de infección y hospitalización”, dijo la Dra. Paula Annunziato, vicepresidenta senior, enfermedades infecciosas y vacunas, Desarrollo Clínico Global, Laboratorios de Investigación de MSD. “Estos hallazgos clínicamente significativos también refuerzan el potencial de clesrovimab para ser la primera y única inmunización diseñada para ayudar a proteger tanto a bebés sanos como en riesgo usando la misma dosis, independientemente del peso. Esperamos continuar discutiendo estos datos con las autoridades sanitarias de todo el mundo con el objetivo de hacer que clesrovimab esté disponible para bebés tan pronto como en la temporada de VRS 2025-26” (Cabe señalar que esta referencia temporal aplica a los Estados Unidos, mientras que en España la disponibilidad se espera tan pronto como sea posible).
Acerca de MK-1654-004
MK-1654-004 (NCT04767373) fue un ensayo clínico de fase 2b/3, doble ciego, aleatorizado, controlado con placebo que evaluó la seguridad y eficacia de clesrovimab en bebés sanos prematuros y a término desde el nacimiento hasta 1 año de edad que ingresan en su primera temporada de VRS. El estudio inscribió a 3.632 participantes que fueron aleatorizados 2:1 para recibir una dosis fija única de clesrovimab (105 mg de inyección intramuscular (IM por sus siglas en inglés)) o placebo el Día 1. Los criterios de valoración principales incluyeron la incidencia de participantes con infección de las vías respiratorias inferiores (MALRI) asociada al VRS atendida médicamente desde el Día 1 (postdosis) hasta el Día 150 en comparación con el placebo y la seguridad. La definición de MALRI requería ≥1 indicador de LRI o gravedad. La hospitalización asociada al VRS hasta el Día 150 y MALRI que requería ≥1 indicador de LRI o gravedad hasta el Día 180, fueron criterios de valoración secundarios preespecificados. Los criterios de valoración terciarios preespecificados incluían infección respiratoria aguda, hospitalizaciones por infección respiratoria baja asociada al VRS y la incidencia de MALRI grave hasta el Día 150. En un análisis post hoc, se evaluaron formas más graves de MALRI asociada al VRS (≥2 indicadores de LRI y gravedad). A lo largo de los criterios de valoración, se evaluaron medidas adicionales de eficacia hasta el Día 180. Las medidas de seguridad incluían el porcentaje de participantes con eventos adversos (EA) relacionados con la inyección solicitados, EA de especial interés (AESIs por sus siglas en inglés) EA sistémicos solicitados o eventos adversos graves (SAEs por sus siglas en inglés).
Acerca de MK-1654-007
MK-1654-007 (NCT04938830) es un estudio de fase III, multicéntrico, aleatorizado, parcialmente ciego, controlado para evaluar la seguridad, eficacia y farmacocinética de clesrovimab en bebés y niños con mayor riesgo de enfermedad grave por VRS en comparación con palivizumab. El estudio inscribió a participantes que estaban entrando en su primera temporada de VRS a quienes se recomendaba recibir palivizumab debido a prematuridad (≤35 semanas de edad gestacional), enfermedad pulmonar crónica (CLD por sus siglas en inglés) de la prematuridad, o enfermedad cardíaca congénita (CHD por sus siglas en inglés) hemodinámicamente significativa. Los participantes fueron aleatorizados 1:1 para recibir clesrovimab (105 mg IM el Día 1, placebo el Día 28) o palivizumab mensual en su primera temporada, y los participantes elegibles recibieron clesrovimab (210 mg IM) en la segunda temporada de VRS. En este análisis interino, 901 participantes fueron inscritos en el ensayo. El criterio de valoración primario es la seguridad y tolerabilidad de clesrovimab versus palivizumab en la primera temporada. Los criterios de valoración secundarios incluyen la incidencia de infecciones respiratorias bajas atendidas médicamente asociadas al VRS (MALRI) que requieren ≥1 indicador de LRI o gravedad y de hospitalización asociada al VRS hasta el Día 150.
Acerca de clesrovimab (MK-1654)
Clesrovimab (MK-1654) es un anticuerpo monoclonal de vida media prolongada en investigación (mAb por sus siglas en inglés) desarrollado como una inmunización pasiva para la prevención del VRS. Clesrovimab está diseñado para ser administrado como una única dosis, independientemente del peso al nacer, y se está estudiando en prematuros sanos, a término y en bebés en riesgo para proporcionar protección directa, rápida y duradera durante su primera temporada de VRS frente a VRS leve, moderado y severo.
Acerca del VRS
El virus respiratorio sincitial (VRS) es un virus contagioso que causa infecciones estacionales generalizadas como la gripe, con una carga mundial en bebés y adultos mayores. Existe una gran necesidad no satisfecha de opciones preventivas tanto en bebés sanos como en aquellos de alto riesgo. A nivel mundial, el VRS es la principal causa de hospitalización en bebés sanos menores de un año. El VRS puede llevar a condiciones respiratorias graves como bronquiolitis y neumonía, causando una estimación de 101.000 muertes al año en todo el mundo en niños menores de cinco años. Según el Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría, aunque el VRS circula durante todo el año, la denominada “temporada del VRS” es en otoño-invierno (de octubre a marzo)[1].
Acerca de MSD
En MSD -conocida como Merck & Co., Inc. en Estados Unidos y Canadá, con sede en Rahway, Nueva Jersey- estamos unidos por nuestro propósito de emplear el potencial de la ciencia para salvar y mejorar vidas en el mundo. Desde hace más de 130 años, hemos aportado esperanza a través del desarrollo de importantes medicamentos y vacunas. Aspiramos a ser la compañía líder de investigación biofarmacéutica del mundo y, en la actualidad, estamos a la vanguardia de la investigación en soluciones innovadoras de salud para avanzar en la prevención y tratamiento de enfermedades humanas y animales. Fomentamos un espacio de trabajo diverso e inclusivo y trabajamos de forma responsable todos los días para conseguir un futuro seguro, sostenible y saludable para todas las personas y comunidades. Para más información, visita www.msd.es conecta con nosotros en X (antes Twitter), LinkedIn y Youtube.
Declaraciones de Futuro de MSD (marca comercial de Merck & Co., Inc., Rahway, N.J., USA)
Esta nota de prensa de MSD, marca de Merck & Co., Inc., Rahway, N.J., USA, (la Compañía), contiene “declaraciones de futuro”, término que se define en la Ley de Reforma de Litigios de Valores Privados de Estados Unidos (1995). Estas declaraciones se basan en las creencias y expectativas actuales de la dirección de la Compañía y están sujetas a riesgos e incertidumbres significativas. Con respecto a los productos en desarrollo, no puede haber ninguna garantía de que dichos productos recibirán las aprobaciones regulatorias necesarias o llegarán a tener éxito comercial.
Los riesgos e incertidumbres incluyen, pero no se limitan, a las condiciones generales de la industria y la competencia; los factores económicos generales, incluidas las fluctuaciones de los tipos de interés y los tipos de cambio; el impacto de la regulación de la industria farmacéutica y la legislación sanitaria en Estados Unidos e internacionalmente; las tendencias mundiales hacia la contención del gasto sanitario; los avances tecnológicos, los nuevos productos y patentes obtenidas por la competencia; los retos inherentes al desarrollo de nuevos productos, incluida la obtención de la aprobación regulatoria; la capacidad de la Compañía para predecir con exactitud las condiciones futuras del mercado; las dificultades o retrasos en la fabricación; la inestabilidad financiera de las economías internacionales y el riesgo soberano; la dependencia de la efectividad de las patentes de la Compañía y otras protecciones para productos innovadores; y la exposición a litigios, incluidos los litigios sobre patentes y/o acciones regulatorias.
La Compañía no asume ninguna obligación de actualizar públicamente ninguna proyección a futuro, ya sea como resultado de nueva información, eventos futuros u otros motivos. Factores adicionales que podrían hacer que los resultados difieran materialmente de los que se describen en las proyecciones de futuro pueden encontrarse en el Formulario 10-K de la memoria anual de la Compañía para el año finalizado a 31 de diciembre de 2023; y en otros documentos de la Compañía presentados ante la Comisión de Bolsa y Valores de los Estados Unidos (SEC) disponibles en su web (www.sec.gov).
Contacto para medios locales
MSD
Sara Cebrián – Jorge Ramírez | 91 321 06 00
ALABRA
Rocío Galán | 673 27 07 45 | rocio.galan@alabra.es
Helena Pastor | 647 24 16 15 | helena.pastor@alabra.es
[1] AEPCAV. VACUNA VIRUS RESPIRATORIO SINCITIAL [Internet]. Vacunasaep.org. [fecha de consulta: enero 2025]. Disponible en: https://vacunasaep.org/familias/vacunas-una-a-una/vacuna-virus-respiratorio-sincitial
